在化学实验和工业生产中,溶液的稀释是常见的操作。为了准确掌握溶液的浓度,我们需要了解溶液稀释浓度的计算公式。本文将通过例题及解析的方式,帮助大家更好地理解和掌握这一知识点。
首先,我们来了解一下溶液稀释浓度的基本概念。溶液的浓度是指单位体积溶液中所含溶质的质量,通常用质量浓度(单位:g/L)或摩尔浓度(单位:mol/L)来表示。
当一个溶液被稀释时,溶质的浓度会降低,而溶剂的浓度保持不变。因此,我们可以通过稀释前后溶液的浓度来计算稀释过程中溶质的质量或摩尔数的变化。

接下来,我们来看一个关于溶液稀释浓度计算的例题
例题1:已知某硫酸溶液的质量浓度为10g/L,现需要将其稀释为5g/L。求稀释后的溶液体积。
解析:设稀释前的溶液体积为V1,稀释后的溶液体积为V2,溶质的质量为m。
根据质量守恒定律,稀释前后溶液中的溶质质量不变,即m = V1 × 10g/L = V2 × 5g/L。解得V2 = m / 5g/L = (V1 × 10g/L) / 5g/L = 2V1。所以,稀释后的溶液体积为原来的2倍。
例题2:已知某盐酸溶液的摩尔浓度为0.1mol/L,现需要将其稀释为0.05mol/L。求稀释后的溶液体积。
解析:设稀释前的溶液体积为V1,稀释后的溶液体积为V2,溶质的摩尔数为n。
根据物质的量守恒定律,稀释前后溶液中的溶质摩尔数不变,即n = V1 × 0.1mol/L = V2 × 0.05mol/L。解得V2 = n / 0.05mol/L = (V1 × 0.1mol/L) / 0.05mol/L = 2V1。所以,稀释后的溶液体积为原来的2倍。
通过以上两个例题,我们可以看到,无论是质量浓度还是摩尔浓度的溶液稀释问题,其核心都是利用质量守恒定律或物质的量守恒定律来解决。在实际应用中,我们可以根据具体情况选择合适的计算公式进行计算。
需要注意的是,在实际操作中,我们还需要考虑溶液的密度、温度等因素对浓度计算的影响。
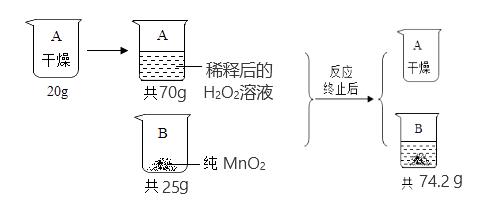
例如,当溶液的温度发生变化时,溶质的溶解度也会随之改变,从而影响溶液的浓度。因此,在进行溶液稀释浓度计算时,我们需要根据实际情况综合考虑各种因素,以确保计算结果的准确性。
总之,掌握溶液稀释浓度计算公式对于化学实验和工业生产具有重要意义。
通过学习和实践,我们可以更好地理解这一知识点,并在实际操作中运用自如。希望本文的介绍和例题解析能对大家有所帮助,祝大家学习进步!
